Actualidad
Mecanismos subyacentes en las infecciones latentes
Dov B. Prusky et al. analizan si la quiescencia de los patógenos poscosecha es un proceso de inhibición fúngica o una respuesta inmune de la fruta huésped inmadura
Los patógenos poscosecha pueden infectar productos frescos tanto antes como después de la cosecha, mediante penetración directa o a través de heridas, permaneciendo inactivos hasta la maduración.
Los patógenos poscosecha de tipo biotrófico persisten bajo las células del huésped y pueden permanecer en estado de inactividad. Detectan señales ambientales y regulan la inactividad mediante el control de la cromatina y la secreción de efectores que interactúan con los receptores de reconocimiento de patrones del huésped.
Por el contrario, los hongos necrotróficos persisten entre las células muertas y dependen más directamente de la disponibilidad de nutrientes para estimular su crecimiento y de la secreción de factores de virulencia fúngica.
Durante la inactividad, el huésped también desarrolla respuestas específicas, como
- la activación de genes de receptores de reconocimiento de patrones,
- la señalización de etileno (particularmente en frutos verdes) y
- genes de defensa como PR-10 y quitinasas.
Las vías del ácido jasmónico y del etileno potencian sinérgicamente estas defensas.
A medida que la fruta madura, se desencadena la transición de la inactividad al crecimiento necrotrófico activo, acelerando la descomposición tisular.
Esta activación se debe a varios factores clave, como
- el debilitamiento de las defensas del huésped,
- la disminución de los niveles de compuestos antifúngicos como los polifenoles,
- la mayor accesibilidad de la pared celular debido al ablandamiento de la fruta y
- los cambios en las vías de señalización asociados a la maduración, que alteran el pH ambiental, el metabolismo del carbono y la producción de metabolitos secundarios.
Estos mecanismos regulan conjuntamente el momento y la magnitud del inicio de la colonización fúngica durante la senescencia de la fruta.
Introducción
Las frutas y hortalizas son productos altamente perecederos, y una manipulación inadecuada durante la cosecha, el transporte o el almacenamiento puede provocar importantes pérdidas y desperdicios poscosecha.
La Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO) estima que aproximadamente un tercio de la producción mundial de alimentos (aproximadamente 1300 millones de toneladas métricas) se pierde o desperdicia cada año (Sagar et al., 2018).
En el caso de los productos hortícolas, las pérdidas pueden alcanzar hasta el 60%, y se producen en diversas etapas de la cadena de suministro, desde la cosecha hasta el consumo doméstico (Prusky y Roma Nazzi, 2023).
Las infecciones fúngicas poscosecha pueden iniciarse antes, durante o después de la cosecha, pero a menudo permanecen latentes en una fase de reposo hasta la maduración y senescencia de la fruta (Prusky, 1996; Prusky et al., 2013).
Esto difiere de los patógenos fúngicos, que presentan un ciclo completo en el tejido vivo; por ejemplo, Ustilago (Yu et al., 2023), que no se aborda aquí.
La prevención de enfermedades suele lograrse mediante una combinación de tratamientos fungicidas y condiciones de almacenamiento optimizadas (Adaskaveg et al., 2023).
Los síntomas suelen hacerse visibles solo después de un almacenamiento prolongado en frío o durante la vida útil, justo antes del consumo.
Cabe destacar que, si bien la mayoría de las frutas y verduras recién cosechadas albergan infecciones latentes, los mecanismos que rigen la quiescencia fúngica y la resistencia del hospedador en frutas inmaduras siguen siendo poco conocidos (Adaskaveg et al., 2000; Prusky et al., 2013).
Aunque los avances recientes han desarrollado materiales de detección estables y robustos con alta sensibilidad para detectar infecciones en frutas por patógenos, hasta la fecha no se han implementado aplicaciones prácticas (Archana et al., 2024).
Esta brecha de conocimiento subraya la importancia de investigar los factores que regulan la quiescencia y su activación, ya que estos conocimientos podrían fundamentar el desarrollo de nuevas estrategias de manejo de enfermedades destinadas a reducir la dependencia de fungicidas poscosecha, preservando al mismo tiempo la calidad de la fruta a lo largo del tiempo (Prusky et al., 2013).
¿Cuáles son los mecanismos de infección de los patógenos poscosecha que se vuelven quiescentes?
Los patógenos poscosecha infectan frutas y hortalizas a través de dos mecanismos principales:
- penetración directa en la cutícula o
- entrada a través de heridas.
Ambos mecanismos pueden ocurrir en las etapas de precosecha y poscosecha.
La especificidad fúngica del hospedador se refiere a la capacidad de un patógeno para infectar únicamente a especies hospedadoras específicas, desde una especificidad limitada, como la de Penicillium digitatum, que infecta únicamente a cítricos, hasta una especificidad amplia, como la observada en Botrytis cinerea, que infecta una amplia gama de hospedadores de frutas y hortalizas (Adaskaveg et al., 2023).
Cuando un patógeno poscosecha específico del hospedador intenta infectar a una especie no hospedadora, el resultado esperado es la muerte del patógeno y la creación de una inmunidad efectiva del hospedador.
La especificidad del hospedador se rige por una compleja interacción de factores genéticos, estructurales y ambientales, incluyendo la capacidad del patógeno para superar las defensas del hospedador y los mecanismos de resistencia genética inherentes de este (Jones y Dangl, 2006; J. Li et al., 2020).
En cultivos de frutas y hortalizas poscosecha, estas interacciones se vuelven aún más complejas debido a las respuestas variables de un mismo hospedador, que van desde inmunes hasta susceptibles en diferentes etapas de desarrollo y maduración (Prusky y Romanazzi, 2023), lo que pone de relieve la complejidad de la dinámica hospedador-patógeno.
En las primeras etapas del desarrollo del fruto, la resistencia del hospedador impide la colonización de patógenos y obliga a los microorganismos a un estado de quiescencia, donde no se observan síntomas externos.
A medida que el fruto madura y envejece, las defensas del hospedador se debilitan y la susceptibilidad aumenta, lo que permite que la colonización de patógenos continúe (Cantu et al., 2008a,b).
Estas infecciones quiescentes se manifiestan en dos patrones distintos:
- infección penetrante localizada (LPI, localized penetrating infection), en la que los hongos penetran tejidos específicos del fruto en diversas etapas de desarrollo (Prusky, 1996); e
- infecciones asintomáticas no localizadas (NLSI, non LSI), caracterizadas por la propagación endofítica a través de los tejidos vasculares, que finalmente atacan el fruto a distancia del sitio de infección inicial.
Este manuscrito se centra en aspectos bien caracterizados de la LPI, mientras que el tipo de infección NLSI no se abordará en esta revisión.
La LPI puede establecerse en múltiples localizaciones de los tejidos vegetales, como pétalos de flores, receptáculos, estambres, cálices, pedúnculos y cutículas (Prusky, 1996).
Estas infecciones se desarrollan mediante la penetración directa de la cutícula o la entrada a través de heridas durante el crecimiento y el acondicionamiento del hospedador, hasta que la maduración del fruto desencadena la aparición de síntomas.
Se ha documentado la existencia de numerosas especies de hongos, como Colletotrichum, Alternaria, Botrytis, Monilinia, Lasiodiplodia y Phomopsis, en este estado latente dentro de sus hospedadores (Adaskaveg et al., 2000; Prins et al., 2000; Prusky et al., 2013).
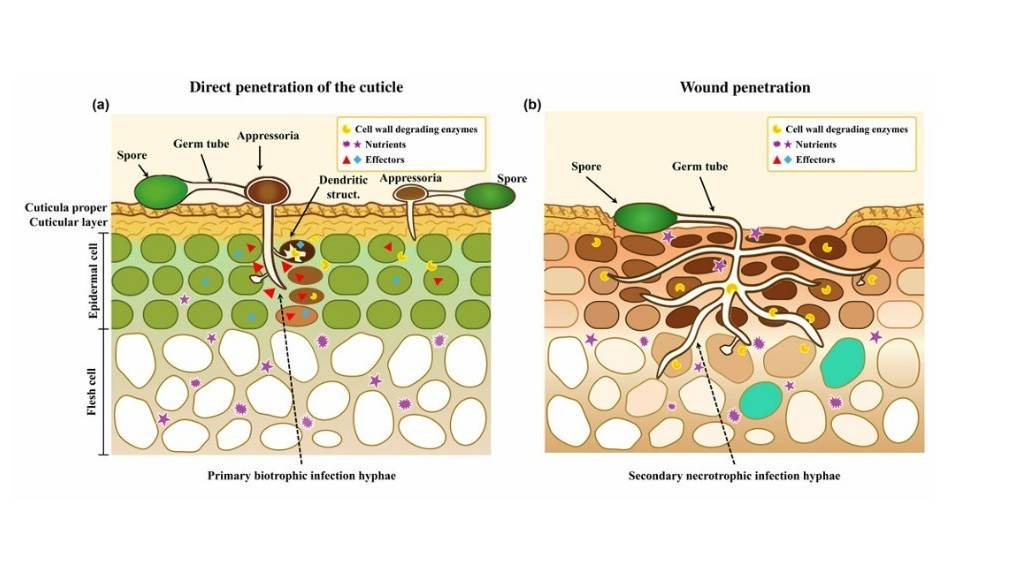
Patógenos biotróficos como Colletotrichum y Monilinia establecen infecciones localizadas penetrando la cutícula o aprovechando heridas menores en la cutícula y heridas significativas en el extremo del tallo (Fig. 1).
Estos patógenos permanecen suprimidos dentro de la cutícula del hospedador o bajo la primera capa de células hospedadoras hasta que la maduración del fruto compromete la resistencia de la planta.
Patógenos necrótrofos como B. cinerea pueden penetrar el líquido estigmático de la flor antes de propagarse asintomáticamente, mientras que en el kiwi, infecta principalmente a través de las heridas en el extremo del tallo (Adaskaveg et al., 2023).
Tanto los patógenos biotróficos como los necrotróficos muestran una etapa temprana de quiescencia durante la fase inmadura del desarrollo del fruto (Prusky y Lichter, 2007; Petrasch et al., 2019).
Se han identificado varias formas de quiescencia:
- retraso en la germinación de conidios o detención del crecimiento de los apresorios tras la germinación;
- crecimiento endofítico asintomático en el apoplasto; y
- colonización de órganos florales en abscisión, como los pétalos, seguida de una detención del crecimiento en los ovarios o receptáculos (Petrasch et al., 2019).
La susceptibilidad inducida por la maduración desencadena la activación de patógenos, lo que subraya la importancia de comprender los mecanismos de quiescencia para un control eficaz de enfermedades poscosecha (Prusky, 1996; Ploetz, 2003; Galsurker et al., 2020).
Las estructuras de infección son factores clave para la adhesión y la ruptura de la cutícula intacta o del tejido dañado, causando una infección fúngica. Las esporas que germinaron en la superficie de la cutícula pueden formar apresorios globulares o lobulados, melanizados o no melanizados (Podilae et al., 1993; Lee y Bostock, 2006; Oliveira Lino et al., 2020).
En el aguacate, los alcoholes grasos de cadena larga (≥ C24) presentes en la cera epicuticular estimulan críticamente la formación de apresorios de Colletotrichum, mientras que las ceras no hospedantes la suprimen (Podila et al., 1993; Prusky, 1996).
Tras la germinación, una hifa con forma similar a un aguja emerge de la base del apresorio y perfora la cutícula.
Tras la diferenciación de los apresorios a partir de los tubos germinativos y su penetración, la estructura puede permanecer latente dentro de la cutícula, como se observa en el aguacate (Daykin, 1984; Prusky, 1996), o desarrollarse posteriormente en estructuras dendríticas en la primera capa celular bajo la cutícula, como se observa en el tomate (Alkan et al., 2015) (Fig. 1a).
La infección temprana generalmente evita la necrosis o las reacciones visibles del hospedador, probablemente debido a que los efectores fúngicos suprimen las defensas de la planta (Kleemann et al., 2012; Giraldo y Valent, 2013); sin embargo, esto puede variar según el fruto hospedador.
Tras su formación, los apresorios germinados en Colletotrichum, Monilinia y Alternaria rompen la cutícula mediante un proceso estrictamente regulado que implica la replicación del ADN, la progresión del ciclo celular mediada por GTPasas (fase G1 a S) y la deposición de melanina (Wao y Köller, 1994; Fan y Köller, 1998; Fetzner et al., 2014; Alkan et al., 2015; Tang et al., 2017; Liet al., 2022).
En B. cinerea, las infecciones quiescentes pueden ocurrir sin apresorios o con almohadillas de infección (CI) unicelulares o multicelulares.
Estas estructuras no melanizadas penetran en los tejidos del hospedador entre 24 y 48 h después de la germinación de las esporas a través de diversos órganos de la planta (Adaskaveg et al., 2000; Haile et al., 2019, 2020; Petrasch et al., 2019; Choquer et al., 2021; Biet al., 2023).
La mayoría de las infecciones por Botrytis en fresas comienzan cuando las esporas germinan en los órganos florales (infecciones primarias) durante o inmediatamente después de la floración, lo que permite que las hifas crezcan hacia el receptáculo (Bristow et al., 1986). Los pétalos, estambres y cálices senescentes infectados pueden facilitar las infecciones primarias en el fruto (Petrasch et al., 2019).
En otros casos, el fluido estigmático aporta nutrientes a los conidios aerotransportados, lo que facilita su crecimiento en el microclima húmedo de la frambuesa (Williamson et al., 2007). La infección se propaga posteriormente al receptáculo antes de detenerse y entrar en un estado de reposo (Bristow et al., 1986; Jarvis, 1994; Prusky, 1996).
En la uva, la germinación e infección directa de Botrytis se relacionó con el grosor de la cutícula, que restringe la difusión de agua y nutrientes a través de los sitios de permeabilidad (Herzog et al., 2015). Mientras que los cultivares con capas de cera hidrofóbica más delgadas promueven la propagación del agua superficial y de nutrientes, lo que aumenta las tasas de infección.
En otros casos descritos de Botrytis, las esporas pueden formar estructuras similares a apresorios, de las cuales las hifas pueden emerger en ángulos casi perpendiculares (Fig. 2a) (Bietal., 2023).
La penetración es impulsada por la presión de turgencia, apoyada por el citoesqueleto de actina, y se acompaña de la secreción de efectores, como fitotoxinas, proteasas y enzimas que degradan la pared celular.
A diferencia de los apresorios melanizados de otros hongos, B. cinerea depende más de la degradación enzimática que de la fuerza mecánica para su penetración.
La infección temprana activa las defensas de la vid, incluyendo proteínas antimicrobianas y refuerzo de la pared celular, que inhiben el crecimiento fúngico hasta que las condiciones favorables reactivan la patogénesis (Haile et al., 2019).
En resumen, los patógenos poscosecha primero detectan al huésped y luego regulan diversos procesos metabólicos para:
- Desarrollar estructuras de penetración;
- Identificar los sitios de entrada óptimos;
- Dotar estas estructuras con cutinasa y lipasas para romper la cutícula del huésped, asegurando una quiescencia exitosa; e
- Inhibir la colonización fúngica y la inmunidad del huésped hasta la maduración del fruto.
Por lo tanto, comprender este mecanismo huésped-patógeno durante la quiescencia y su activación resulta crucial para prevenir la descomposición del fruto durante su vida útil poscosecha (Bruton et al., 1998; Prusky et al., 2010).
Contenido
Dinámica de la infección quiescente
Quiescencia en Colletotrichum
Quiescencia en Botrytis
Quiescencia en Monilinia
Quiescencia en patógenos que penetran a través de heridas
Finalización de la quiescencia e inicio de la virulencia
Conclusiones
Los patógenos poscosecha infectan los productos en condiciones pre y poscosecha, entrando en quiescencia hasta que la maduración debilita las defensas del huésped.
Los patógenos emplean apresorios melanizados, presión de turgencia y detección de nutrientes para romper las cutículas.
Los biótrofos persisten bajo la cutícula de las células huésped, mientras que los necrótrofos, como B. cinerea, emplean factores inductores de muerte celular, potenciados por sitios diana ricos en nutrientes, para facilitar la penetración, pero permanecen latentes hasta la maduración, activándose solo en condiciones favorables.
La pregunta es si la quiescencia es un proceso de inhibición fúngica o una respuesta inmunitaria del fruto huésped inmaduro.
A pesar de los factores que inhiben la penetración fúngica e influyen en las condiciones de quiescencia, los patógenos biótrofos, como Colletotrichum, detectan su entorno y reprograman su actividad mediante la regulación de la cromatina.
Por el contrario, los necrótrofos, como Botrytis y Penicillium, mantienen la quiescencia en lugares vinculados a la disponibilidad de nutrientes, lo que permite la expresión temprana de factores de virulencia clave que pueden regular las etapas de activación de la quiescencia.
Las respuestas del hospedador durante la quiescencia incluyen genes de reconocimiento celular y señalización de ET —generalmente activa en frutos verdes— junto con genes de defensa (p. ej., PR-10), con defensas sinérgicas de JA/ET y ABA que inducen la deposición de calosa epidérmica, y compuestos antifúngicos regulados positivamente que, en conjunto, previenen la activación de la quiescencia.
Las hifas biotróficas de Colletotrichum secretan efectores (p. ej., ChELP2) que interactúan con los PRR del hospedador, probablemente contribuyendo a la modulación de la quiescencia.
En patógenos necrotróficos, NPR1, un regulador central de la defensa de las plantas, actúa como un receptor de SA y ajusta la resistencia mediada por JA y ET contra los necrótrofos mediante la regulación positiva de genes relacionados con la defensa, como las proteínas PR y las β-1,3-glucanasas.
En diferentes patotipos, el inicio y la progresión de la maduración del fruto sirven como el principal desencadenante para que los patógenos pasen del reconocimiento inmunitario del huésped a un estilo de vida necrotrófico activo.
Sin embargo, la pérdida de la quiescencia en el fruto en maduración parece deberse no a mecanismos de respuesta específicos en frutos susceptibles, sino a una menor expresión de las mismas vías de defensa.
La salida de la quiescencia se atribuye a:
- mayor acceso a los sustratos de la pared celular debido al ablandamiento del fruto;
- debilitamiento de las defensas del huésped;
- reducción de compuestos antifúngicos; y
- activación de factores de virulencia que modifican al huésped.
La inhibición del crecimiento fúngico durante la respuesta inmunitaria del fruto depende en gran medida del metabolismo del huésped.
Por lo tanto, comprender mejor los mecanismos que subyacen a la inmunidad del fruto durante la quiescencia es fundamental para prevenir el resurgimiento de los patógenos, una causa importante de enfermedades poscosecha y pérdidas que alcanzan hasta el 60 % de los cultivos cosechados.
La imagen es la Fig. 1 del artículo original: Colletotrichum y Monilinia establecen infecciones quiescentes en el fruto mediante penetración directa o heridas menores, utilizando hifas originadas por esporas en germinación.
Los apresorios coloreados indican melanización de la estructura.
Una tinción más oscura de las células hospedadoras indica células en proceso de muerte.
Las hifas germinadas permanecen latentes bajo la cutícula o penetran en una o dos capas celulares, utilizando su capacidad biotrófica para penetrar las células y formar estructuras dendríticas antes de que estas se necroticen.
El número limitado de células muertas en cada sitio de infección previene la formación de lesiones necróticas visibles durante la infección quiescente.
La penetración de la herida se produce sin formación de apresorios.
La acumulación de especies reactivas de oxígeno (ROS, reactive oxygen species) en el tejido lesionado causa daño molecular, lo que finalmente provoca la muerte celular y facilita la colonización fúngica inicial (Wang et al., 2019).
Tras este proceso, se produce la penetración biotrófica directa en las células.
Colletotrichum secreta nuevas proteínas efectoras que inducen la muerte celular (Takahara et al., 2021; Wang et al., 2024), pero estas se producen principalmente cuando el hongo sale de su estado de quiescencia.
Fuente
Quiescence of postharvest pathogens: a fungal inhibition process or an
immune response of the unripe host fruit?
Dov B. Prusky, Tong Chen, Shiping Tian, Yong Chen and Boqiang Li
NewPhytologist (2026)
doi: 10.1111/nph.70913















.gif)



